Le respect de l’éthique en recherche est indispensable au développement des connaissances, à l’innovation scientifique et à l’excellence en recherche. Le FRQ souhaite voir toute la communauté scientifique adhérer à la culture de l’éthique en recherche. La mobilisation attendue requiert d’intégrer la réflexion éthique à toutes les étapes de la recherche.
Les titulaires d’octroi doivent se conforment aux normes d’éthique adoptées par chacun des secteurs du FRQ. En plus, le FRQ s’attend à ce que les titulaires d’octroi souscrivent aux pratiques exemplaires en matière d’éthique de la recherche en respectant les différentes normes applicables, selon le contexte.
Normes adoptées par chacun des secteurs
- Le secteur Société et culture applique cette norme: Énoncé de politique des trois conseils : Éthique de la recherche avec des êtres humains – EPTC 2 (2022)
- Éthique de la recherche sociale: consentement libre et éclairé, confidentialité et vie privée (2002)
Normes à considérer, selon le contexte
- Conditions d’exercice des comités d’éthique de la recherche désignés ou institués par le ministre de la Santé et des Services sociaux en vertu de l’article 21 du Code civil – Avis (Gazette officielle, 1998)
- Code civil du Québec
- Loi sur l’accès aux documents des organismes publics et sur la protection des renseignements personnels
- Loi sur la protection des renseignements personnels dans le secteur privé
- Loi sur les activités cliniques et de recherche en matière de procréation assistée
- Énoncé de politique des trois conseils : Éthique de la recherche avec des êtres humains – EPTC 2 (2022)
- Comment donner suite aux découvertes fortuites significatives (Groupe consultatif en éthique de la recherche, 2018)
- Les enjeux éthiques entourant la recherche en santé sur les enfants (Société canadienne de pédiatrie, 2018)
- Pratiques exemplaires des IRSC en matière de protection de la vie privée dans la recherche en santé (2005)
- Code de Nuremberg (1947)
- Rapport Belmont : Principes éthiques et directives concernant la protection des sujets humains dans le cadre de la recherche (Commission nationale pour la protection des sujets humains dans le cadre de la recherche biomédicale et béhavioriste, 1979)
- Déclaration d’Helsinki de l’AMM – Principes éthiques applicables à la recherche médicale impliquant des êtres humains (Association médicale mondiale, 2013)
- Déclaration universelle sur la bioéthique et les droits de l’homme (Organisation des Nations Unies pour l’éducation, la science et la culture, 2003)
- Déclaration de l’AMM sur les considérations éthiques concernant les bases de données de santé et les biobanques (Association médicale mondiale, 2016)
- Lignes directrices internationales d’éthique pour la recherche en matière de santé impliquant des participants humains (CIOMS et OMS, 2016)
- Convention pour la protection des droits de l’Homme et de la dignité de l’être humain à l’égard des applications de la biologie et de la médecine : Convention sur les droits de l’Homme et la biomédecine (Conseil de l’Europe, 1997)
- Protocole additionnel à la Convention sur les droits de l’homme et de la dignité de l’être humain à l’égard des applications de la biologie et de la médecine, portant sur l’interdiction de clonage humain (Conseil de l’Europe, 1998)
- Protocole additionnel à la Convention sur les Droits de l’Homme et la biomédecine, relatif à la recherche biomédicale (Conseil de l’Europe, 2005)
- Cadre de référence ministériel pour la recherche avec des participants humains (Ministère de la Santé et de Services sociaux, 2020)
- Cadre de référence des établissements publics du RSSS pour l’autorisation d’une recherche menée dans plus d’un établissement (Ministère de la Santé et de Services sociaux, 2016)
- Loi sur les services de santé et les services sociaux
Réglementation fédérale:
- Ligne directrice E6(R2): Les bonnes pratiques cliniques (ICH, 2016)
- Règlement sur les aliments et drogues
- Règlement sur les produits de santé naturels
MSSS:
Clauses légales types:
En février 2021, une version révisée des clauses légales types destinées aux formulaires de consentement lors d’essais cliniques a été publiée. Le FRQS requiert que ces clauses légales types soient utilisées lors d’essais cliniques financés par le FRQS ou qui se déroulent dans des centres de recherche financés par le FRQS. Elles ont été mises à jour, sous la coordination de CATALIS Québec, par un groupe de travail comprenant des experts (éthique, recherche et juridique), ainsi que des représentants du ministère de la Santé et des Services sociaux (MSSS), du FRQS et de compagnies pharmaceutiques.
Ce document porte essentiellement sur le texte du formulaire de consentement. Toutefois, l’utilisation d’un texte approprié ne constitue qu’une partie du processus plus large de sollicitation d’un consentement éclairé. Les équipes de recherche doivent communiquer l’information contenue dans le formulaire de consentement d’une façon qui facilite sa compréhension. Le recours à des outils d’information adaptés aux personnes qui sont sollicitées, de même que la qualité et le caractère continu de l’échange d’information avec l’équipe de recherche, s’avèrent déterminants dans le processus de sollicitation du consentement.
Ressources disponibles:
- Clauses légales types des formulaires d’information et de consentement dans le cadre d’essais cliniques (MSSS, 2021)
- Version en format Word des clauses légales types (MSSS, 2021)
- Tableau comparatif des principales modifications (MSSS, 2021)
- Page web du ministère de la Santé et des Services sociaux
Le FRQS continue de s’impliquer dans l’actualisation de ces outils destinés à la communauté scientifique. Vous pouvez nous transmettre tout commentaire sur leur contenu à l’adresse suivante : emmanuelle.levesque@frq.gouv.qc.ca.
Provincial (Québec):
- Loi sur les activités cliniques et de recherche en matière de procréation assistée
- Règlement sur les activités cliniques en matière de procréation assistée
Fédéral:
- Déclaration internationale sur les données génétiques humaines (Organisation des Nations Unies pour l’éducation, la science et la culture, 2003)
- Déclaration universelle sur le génome humain et les droits de l’homme : des principes à la pratique (Organisation des Nations Unies pour l’éducation, la science et la culture en 1997 et Organisation des Nations Unies en 1998)
- Lignes directrices de l’OCDE sur les biobanques et bases de données de recherche en génétique humaine (Organisation de Coopération et de Développement Économiques, 2009)
- Énoncé de principes: Recherche en génomique humaine (Réseau de médecine génétique appliquée, 2000)
- Énoncé de principes sur la conduite éthique de la recherche en génétique humaine concernant des populations (Réseau de médecine génétique appliquée, 2003)
- Énoncé de principes sur la recherche en génétique avec les enfants (Réseau de médecine génétique appliquée, 2007)
- Énoncé de principes sur l’utilisation secondaire de données et de matériel biologique recueillis dans un contexte de soins ou de recherche (Réseau de médecine génétique appliquée, 2010)
- Énoncé de principes du RMGA sur la communication des résultats de recherche et des découvertes fortuites (Réseau de médecine génétique appliquée, 2013)
- Prise de position du RMGA sur la discrimination génétique (Réseau de médecine génétique appliquée, 2016)
- Énoncé de principes consolidé du Réseau de médecine génétique appliquée (Réseau de médecine génétique appliquée, 2016)
- La santé et le bien-être à l’ère de l’information génétique : enjeux individuels et sociaux à gérer (Conseil de la santé et du bien-être, 2001)
- Encadrement des banques de données et des banques de matériel biologique à des fins de recherche en santé – Brochure (2006)
- Encadrement des banques de données et des banques de matériel biologique à des fins de recherche en santé – Rapport final du groupe-conseil (2006)
- Encadrement des banques de données et des banques de matériel biologique à des fins de recherche en santé – Sommaire (2006)
Tout projet impliquant des animaux requiert obligatoirement l’approbation du comité de protection des animaux de l’établissement de la candidate ou du candidat principal (section 5.5 des Règles générales communes). Les décisions de ce comité doivent être conformes aux politiques et directives du Conseil canadien de protection des animaux (CCPA) et l’établissement où se réalise la recherche doit avoir reçu l’accréditation du CCPA.
Comités
Le Comité central d’éthique de la recherche relève de la compétence du ministre de la Santé et des Services sociaux. Il évalue l’acceptabilité éthique des projets de recherche impliquant des enfants ou des adultes inaptes à consentir qui se déroulent des établissements qui ne possèdent pas de comité d’éthique désigné par le ministre de la Santé et des Services sociaux (conformément à l’article 21 du Code civil du Québec). Son mandat couvre aussi d’autres situations, incluant l’évaluation de projets dont l’établissement ne dispose pas d’un comité d’éthique.
Pour plus d’information:
- Page web du Comité central d’éthique
- Johane de Champlain (vice-présidente) jdechamplain@frq.gouv.qc.ca
- Téléphone : 514 873-2114, poste 4152
Cellulaire : 514 824-9438
Les projets de recherche qui sont susceptibles de porter atteinte à l’intégrité d’une personne de moins de 18 ans ou d’un adulte inapte à consentir doivent être approuvés et suivis par un comité d’éthique de la recherche institué ou désigné par le ministre de la Santé et des Services sociaux (conformément à l’article 21 du Code civil du Québec).

Vérification menée en 2022
Le FRQ a effectué une vérification portant sur le respect des exigences touchant l’éthique qui découlent des Règles générales communes et des engagements pris par les établissements gestionnaires :
- il faut obtenir une approbation éthique avant le début des activités de recherche qui nécessitent une telle approbation éthique, et;
- l’établissement gestionnaire doit mettre en place des mesures de contrôle advenant qu’il libère les fonds d’une subvention avant l’approbation éthique, afin de s’assurer qu’aucune activité nécessitant une telle approbation éthique ne débute.
La vérification a porté sur 14 octrois (bourses et subventions), sélectionnés aléatoirement parmi plusieurs disciplines.
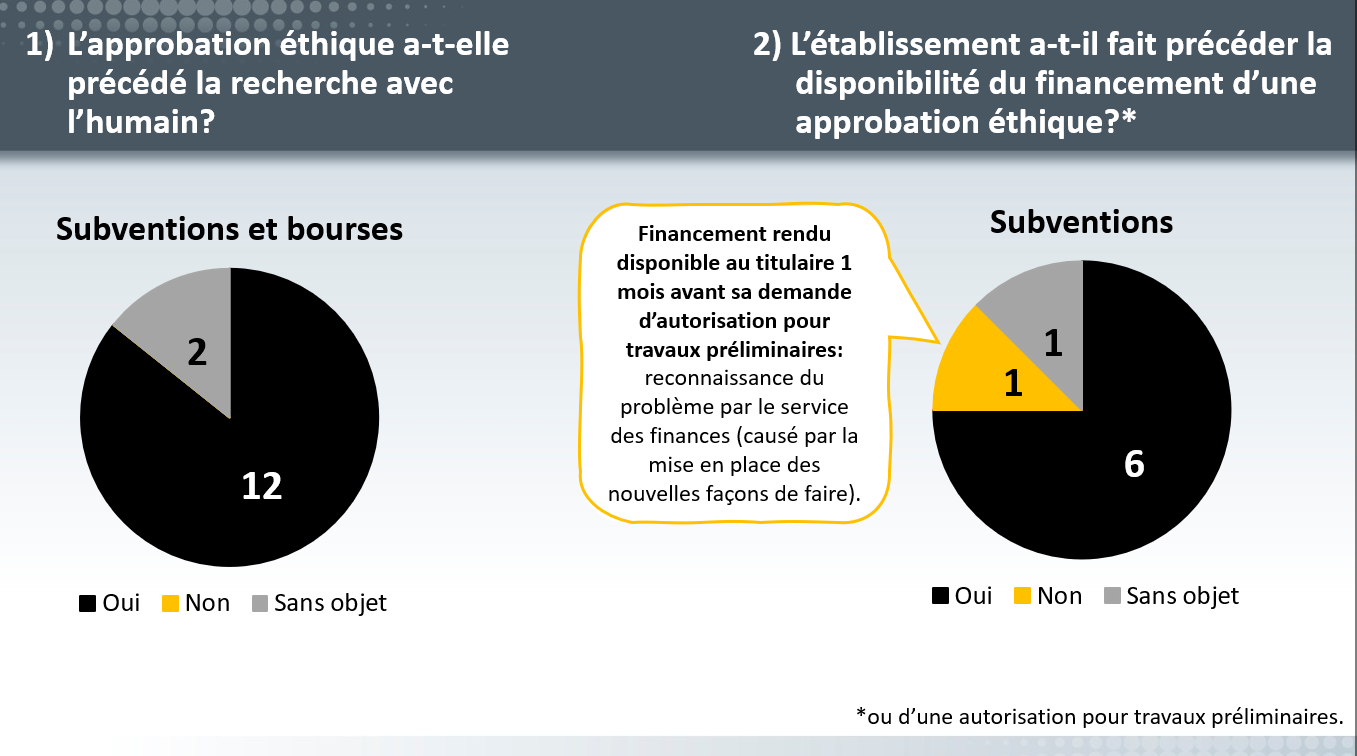
Résultats de cette vérification
Au final, l’exigence « 1 » a été rencontrée dans les 14 octrois examinés. Quant à l’exigence « 2 », seulement un seul octroi a démontré un cas de non-conformité (identifié par l’établissement lui même).
Cette non-conformité n’a pas porté à conséquence puisque la personne titulaire d’octroi s’était assurée d’obtenir une approbation éthique avant de débuter la recherche avec l’humain.
Ces résultats satisfaisants démontrent l’importance accordée par les établissements et la communauté scientifique à mener des recherches de façon responsable.
Ressources en éthique
- Didactitiel – Formation en éthique de la recherche (Ministère de la Santé et des Services sociaux)
- Répertoire des ressources du réseau de la santé et des services sociaux en éthique et autorisation des recherches (Ministère de la Santé et des Services sociaux)
- Page sur l’éthique en santé et services sociaux (Ministère de la Santé et des Services sociaux)
- Entente de reconnaissance de certification d’éthique (Fédération des cégeps, 2019)
- Commission de l’éthique en sciences et en technologies
Visionnez nos modules de sensibilisation!
Pour toute question, communiquer avec Emmanuelle Lévesque, conseillère en éthique de la recherche:
514 873-2114 poste 4280 ou emmanuelle.levesque@frq.gouv.qc.ca.
